El valor más grande de un profesional es su potencial de hacer la diferencia y usarlo para sumar en su ámbito de acción.
Autor: Lourdes Molina, 16 ABR 2024
Los errores sistémicos no suceden de la noche a la mañana; se van gestando poco a poco y sus consecuencias se antojan de poco alcance y de bajo impacto cuando se evalúan varios pequeños errores por separado ya que, ocurren en diferentes áreas y en diferentes momentos históricos, pero van ganando tanta inercia que un día se genera una crisis con efecto un dominó, por tener un gran alcance y un impacto muy alto para la organización.
La gestión de las operaciones con enfoque a procesos, la gestión eficaz del sistema de gestión de calidad, la comprensión de los requerimientos normativos aplicables, la adecuada supervisión y el liderazgo son elementos que blindan a las empresas de los errores sistémicos y a los efectos devastadores de los mismos.

Para ilustrar este arquetipo, les comparto la historia basada en hechos reales en la que se suplantan los nombres de los actores y de la empresa.
Margot, la Responsable Sanitario del Laboratorio Leiko, recibió una visita de balance de controlados en la que el resultado no fue satisfactorio, lo que ocasionó que COFEPRIS levantara una medida de seguridad sanitaria que además derivó en una multa millonaria. El impacto de la medida de seguridad sanitaria implicó el desabasto del mercado por un periodo de 18 meses con un impacto cuantificable en la pérdida de oportunidad de venta y un impacto no cuantificable pero muy alto para los pacientes, en cuanto al acceso a los medicamentos sujetos a restricción. Esta situación también generó la necesidad de hacer la disposición final de inventarios de materias primas, graneles y producto terminado por corta caducidad o expiración de la vida de anaquel y de asumir altos costos asociados a la remediación del sistema de gestión de medicamentos controlados. El impacto financiero para la organización fue de varias decenas de millones de dólares.
El problema comenzó con una visita de verificación sanitaria en un almacén en donde los verificadores encontraron inventarios de medicamento controlado facturado a un laboratorio que no contaba con Licencia Sanitaria y que, le habían sido vendidos por el titular del registro sanitario. Esta situación ocasionó que COFEPRIS enviara una visita para balance de controlados al titular del registro sanitario, el Laboratorio Leiko.
Al hacer la investigación de causa raíz, se identificaron diferentes errores debido a falta de conocimiento de la regulación aplicable, que se vieron reflejados en un registro deficiente de datos en los libros autorizados de control y en el inadecuado manejo de la documentación que demuestra la adquisición, posesión y uso, así como, la trazabilidad en la distribución y comercialización de medicamentos controlados. De acuerdo con los resultados de la investigación de causa raíz se generó un plan CAPA, que se fue implementando poco a poco hasta lograr su completitud. La implementación del plan CAPA implicó un gran esfuerzo para el equipo de trabajo involucrado y como es de esperarse, la COFEPRIS levantó la medida de seguridad sanitaria después de 12 meses de tareas de remediación. El primer desafío que el Laboratorio Leiko tuvo que encarar fue que, no contaba con inventarios de materia prima, ni producto para reiniciar las operaciones de fabricación y distribución, así que, se tuvieron que solicitar las autorizaciones de los permisos sanitarios de importación correspondientes y eventualmente las autorizaciones de uso y comercialización; por lo que les tomó 6 meses adicionales el poder reiniciar sus operaciones de gestión de controlados. Les tomó al menos 12 meses más, regularizar el abasto del canal y el acceso a los pacientes.
En esta historia, hubo la intervención externa del Corporativo, de una agencia de consultoría y de un despacho de abogados; y aun así, lo que la experiencia quedó a deber, es la sustentabilidad del plan de remediación ya que al final, la gestión de controlados requiere un control riguroso, indicadores claros, personal calificado, programas de vigilancia interna como autoinspecciones, balances de controlados periódicos, capacitación continua y supervisión disciplinada. En cuanto al personal calificado, es importante mencionar que se requiere el involucramiento de colaboradores directamente vinculados con la gestión de controlados a lo largo de la cadena de suministro.
En cuanto al poder de gestión, es importante decir que Margot no contó con los recursos adecuados para construir la infraestructura y capacidad necesarios para alinear la operación de rutina, la gestión de datos en el ERP y los registros en los libros autorizados de control por lo que el Laboratorio Leiko asumió un riesgo alto de reincidir en la crisis ya vivida.
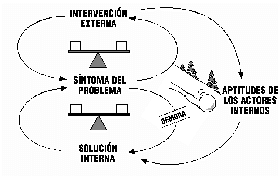
La moraleja de esta historia es que el manejo de medicamentos controlados exige el involucramiento total del Responsable Sanitario y la Dirección, el compromiso de un equipo interdisciplinario con la gestión de sustancias controladas, la implementación de indicadores de medición e indicadores clave de desempeño que se evalúen con la periodicidad adecuada, la gestión eficaz de la irregularidades detectadas y por supuesto, es un punto que no debe faltar en la agenda de la revisión por la Dirección.
Concluyo con dos frases célebres: “El costo de prevenir siempre será más bajo que el costo de remediar” y “El poder de gestión sin la autorización de los recursos necesarios, amenaza la sustentabilidad de las operaciones de la organización y su supervivencia misma”.
Si te gustó este artículo dale “like” y comparte. Te invito a visitar el perfil de Pharma CLIM Serrvices en Linkedin y a suscribirte a La Gaceta del Concejal que es nuestra newsletter quincenal; en ambos medios compartimos información de interés para la Industria Farmacéutica. Finalmente, pregunta por nuestro servicio de balance de controlados y nuestros cursos de gestión de controlados al +52 55 2864 9003 (Lourdes Molina) y +52 55 3989 2647 (Jesús Quintana) o escríbenos a contacto@pharmaclims.com
